Wissenschaftler des Universitätsklinikums Carl Gustav Carus Dresden im Nationalen Centrum für Tumorerkrankungen Dresden (NCT/UCC) haben gemeinsam mit einem internationalen Forscherteam in Laborversuchen einen bislang unbekannten Überlebensmechanismus im Zellkern besonders aggressiver Tumorzellen entschlüsselt. Eine wichtige Rolle hierbei spielt das proteinspaltende Enzym Caspase 8, das sich ausschließlich bei aggressiven Krebszellen im Zellkern anreichert. Ließe sich das Enzym an dieser Stelle chemisch hemmen, wäre es denkbar, verschiedene Krebserkrankungen auch in fortgeschrittenen Stadien wirkungsvoll zu bekämpfen. Die Aufdeckung des Mechanismus bietet daher einen vielversprechenden Ansatz für die Entwicklung neuer zielgerichteter Therapien. Neben dem schwarzen Hautkrebs (malignes Melanom) und Prostatatumoren konnte der entsprechende Mechanismus für weitere Tumorarten, darunter Bauchspeicheldrüsenkrebs, Blasenkrebs, Brustkrebs, Darmkrebs, Eierstockkrebs, Hodenkrebs, Lungenkrebs, Nierenkrebs und Tumoren des Hirns nahegelegt werden. Die Ergebnisse der Untersuchung sind am heutigen Mittwoch (22. Januar 2020) auf der Website des Fachmagazins „Molecular Cell“ (www.cell.com, DOI 10.1016/j.molcel.2019.12.023) veröffentlicht worden.
Tumorzellen vermehren sich meist besonders schnell und setzen dabei Kontrollmechanismen außer Kraft, mit denen der Körper die Teilung kranker Zellen zu verhindern sucht. Häufig spielen hierbei Mutationen des im Zellkern enthaltenen Proteins p53 eine Rolle, das eine wichtige Kontrollfunktion im Zellzyklus ausübt. Gerade in besonders aggressiven Krebszellen, die bei metastasierenden Tumorerkrankungen wie dem malignen Melanom eine wichtige Rolle spielen, liegt p53 allerdings zumeist in seiner funktionsfähigen Normalform vor. Trotzdem kann es seiner Wächterfunktion offensichtlich nicht nachkommen. Verantwortlich hierfür ist ein bislang unbekannter Mechanismus, der bewirkt, dass der p53-Spiegel im Kern besonders aggressiver Krebszellen zu gering ist, um geschädigte Krebszellen in den programmierten Zelltod – eine Art Selbstmordprogramm der Zelle – zu treiben.
Eine wichtige Rolle in diesem Mechanismus spielt das Enzym Caspase 8, das normalerweise nur im Zytoplasma – der den Zellkern umgebenden Grundsubstanz der Zelle – vorkommt, sich bei aggressiven Krebszellen jedoch im Zellkern anreichert. „Wir konnten erstmals zeigen, dass Caspase 8 im Zellkern ein spezielles Protein – USP28 – spaltet, das dafür verantwortlich ist, den p53-Spiegel in Krebszellen mit erhöhter DNA-Schädigung anzureichern. In der Folge wird p53 zu stark abgebaut und kann seine Kontrollfunktion nicht mehr ausüben. Zellen mit geschädigter DNA werden dann nicht mehr in den programmierten Zelltod getrieben, sondern stattdessen der Zellteilung zugeführt“, erklärt Prof. Dagmar Kulms, Leiterin des Bereichs „Experimentelle Dermatologie“ des Universitätsklinikums Carl Gustav Carus Dresden im Nationalen Centrum für Tumorerkrankungen Dresden (NCT/UCC). „Wie wirkungsvoll dieser Mechanismus ist, zeigen die schlechten Überlebensraten von Patienten, bei denen sich eine Anreicherung von Caspase 8 im Zellkern von Tumorzellen nachweisen lässt. Gerade diese Zellen finden sich oft auch gehäuft in der restlichen Tumormasse, die sich bei vielen aggressiven Krebserkrankungen der zunächst erfolgreichen Behandlung entzieht“, sagt Dr. Mads Daugaard vom Vancouver Prostate Centre (Kanada).
Die Wissenschaftler konnten den Mechanismus im Labor anhand zahlreicher Zelllinien sowie Patientengewebe für das maligne Melanom und Prostatakrebs belegen. Zum gleichen Ergebnis führten Untersuchungen an Zelllinien weiterer Tumorarten, darunter Bauchspeicheldrüsenkrebs, Blasenkrebs, Brustkrebs, Darmkrebs, Eierstockkrebs, Hodenkrebs, Lungenkrebs, Nierenkrebs und Tumoren des Hirns.
Besonders vielversprechend ist, dass Caspase 8 nur bei besonders aggressiven Krebszellen im Zellkern vorkommt und dort das Protein USP28 spaltet. Ließe sich die Interaktion von Caspase 8 und USP28 mit einem chemischen Wirkstoff hemmen, könnten die aggressiven Tumorzellen künftig sehr gezielt bekämpft werden. „Dies könnte im Idealfall dazu führen, dass bei metastasierten Krebserkrankungen, bei denen heutige Tumortherapien versagen, möglicherweise das Wachstum und die Ausbreitung gestoppt werden könnten. Der Mechanismus spielt in einer Vielzahl von Krebsarten eine Rolle. Daher sind unsere Ergebnisse von besonders großer klinischer Relevanz“, sagt Prof. Stefan Beissert, Direktor der Klinik für Dermatologie des Universitätsklinikums Dresden. Gemeinsam mit spezialisierten Chemikern wollen die Wissenschaftler künftig an einem entsprechenden Wirkstoff forschen.
Veröffentlichung
Ines Müller, Elwira Strozyk, Sebastian Schindler, Stefan Beissert, Htoo Zarni Oo, Thomas Sauter, Philippe Lucarelli, Sebastian Raeth, Angelika Hausser, Nader Al Nakouzi, Ladan Fazli, Martin E. Gleave, He Liu, Hans-Uwe Simon, Henning Walczak, Douglas R. Green, Jiri Bartek, Mads Daugaard and Dagmar Kulms: Cancer cells employ nuclear caspase-8 to overcome the p53-dependent G2/M checkpoint through cleavage of USP28
Molecular Cell DOI 10.1016/j.molcel.2019.12.023
Zur Pressemitteilung stehen zwei Bilder in druckfähiger Auflösung zur Verfügung:
https://www.nct-dresden.de/fileadmin/media/nct-dresden/das-nct/newsroom/pressemitteilungen/pm-220120.jpg
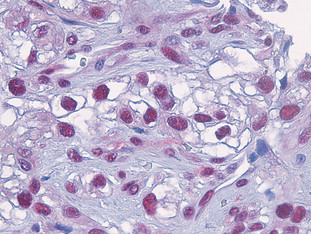
BU 1: Blick in Tumorgewebe des malignen Melanoms: Das Enzym Caspase 8 (dunkelrote Punkte) reichert sich in den Zellkernen an und aktiviert den für Patienten fatalen Überlebensmechanismus der Zelle.
https://www.nct-dresden.de/fileadmin/media/nct-dresden/das-nct/newsroom/pressemitteilungen/pm-220120-caspase8.JPG
BU 2: Ein neu entdeckter Mechanismus zeigt, wie das Enzym Caspase 8 am so genannten G2/M-Schadenskontrollpunkt die Wächterfunktion des Proteins p53 blockiert, den programmierten Zelltod verhindert und die geschädigten Krebszellen stattdessen in den Zellzyklus überführt.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das NCT/UCC Dresden gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung. Bitte geben Sie als Bildnachweis an: Quelle Bild 1: „Institute of Pharmacology University of Bern“, Quelle Bild 2: „Molecular Cell““. Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der NCT/UCC-Pressestelle (Tel. 0351 458 5548, E-Mail: anna.kraft@nct-dresden.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.
Ansprechpartner für die Presse:
Dr. Anna Kraft
Nationales Centrum für Tumorerkrankungen Dresden (NCT/UCC)
Presse- und Öffentlichkeitsarbeit
Tel.: +49 (0)351 458-5548
E-Mail: anna.kraft@nct-dresden.de
www.nct-dresden.de
vom 22.01.2020